
行业发展趋势
国外:国外临床研究数据的电子化管理产生于20世纪70年代,在美国50%以上的临床试验在使用EDC,自从2004年起市场每年12%的增长率,且2009年会持续增长。2009年,I-III期临床研究在EDC系统的投入超过50亿美元,国外FDA已经开始优先评审EDC产生的电子申报材料
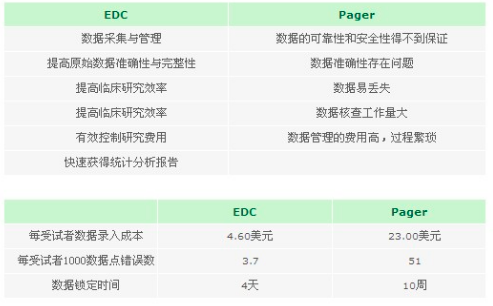
中国:中国超过95%的临床试验采用纸质CRF,数据管理软件使用:Epiinfo, Epidata,Excel,FoxPro,Access 等SFDA及制药企业、研发机构、数据管理和统计分析部门都日益认识到了临床数据规范化管理的重要意义,临床数据管理电子化是新药临床研究发展的必然趋势。 产品背景介绍 Clinical是openclinica edc&dm的中国支持服务组织,帮助生命科学机构建立临床数据采集与数据管理信息平台。该软件是基于web网络的,旨在支持在不同的研究环境中所有类型的临床研究。系统从构建设计之初就充分考虑了生命科学在行业特殊性,系统是建立在稳定性、可兼容性、可扩展性、开放性,及完全符合法规的基础上的(21 CFR Part 11)。在经过超过全球1000家生命科学机构的应用,及超过5000数据采集及数据管理试验的验证后,取得了一致的好评及认可。
主要功能介绍: 数据提交:受试者数据收集,提交,验证及疑问管理; 监控和管理数据:对试验中的数据进行监督和管理; 提取数据:支持数据提取和数据集过滤; 试验建立:创立试验基本信息,设置各研究中心(sites)、研究者(investigators),定义及设计CRFs; 系统管理:对整个系统的监督,审核,配置和管理。 录活的设置及受权临床研究试验下的各参与中心,中心研究者,电子CRFs,受试者入组计划信息; 支持将临床试验中各地研究资源共享,提供试验协同服务; 通过Excel定义方式,基于web由试验管理人员使用excel表格模板定义电子CRFs的数据收集点和验证信息; 管理的复杂和反复的受试者访视信息; 提供强大的数据导入/导出的临床数据集迁移工具,在Excel电子表格数据库和本地传统数据格式进行转换处理; 广泛的接口用于数据查询和检索,为试验协同提供丰富的数据格式。如制表符分隔的,SPSS和的CDISC ODM的XML格式。 法律符合,系统能够符合美国FDA关于临床研究信息系统的要求第11部分的规管指引,如21章节。在系统中按功能应用定义了不同的用户角色和权限,密码和用户身份验证安全,电子签名,SSL加密)deidentification的受保护的健康信息(PHI,全面审计,以记录和监测接入和数据的变化; 一个强大和可扩展的技术基础设施的开发使用Java J2EE架构的IT环境的互操作试验与关系数据库包括PostgreSQL的(开放源码)和Oracle 10g,来支持各种临床。
1、自动:在上方保障服务中标有自动发货的商品,拍下后,将会自动收到来自卖家的商品获取(下载)链接;
2、手动:未标有自动发货的的商品,拍下后,卖家会收到邮件、短信提醒,也可通过QQ或订单中的电话联系对方。
3、在未拍下前,双方在QQ上所商定的内容,亦可成为纠纷评判依据(商定与描述冲突时,商定为准);
4、在商品同时有网站演示与图片演示,且站演与图演不一致时,默认按图演作为纠纷评判依据(特别声明或有商定除外);
5、在没有"无任何正当退款依据"的前提下,写有"一旦售出,概不支持退款"等类似的声明,视为无效声明;
6、虽然交易产生纠纷的几率很小,但请尽量保留如聊天记录这样的重要信息,以防产生纠纷时便于网站工作人员介入快速处理。
 免费试用
免费试用
 微信咨询
微信咨询

手机扫码加我微信
咨询赠送神秘大礼
 牌照办理
牌照办理

微信扫码进入互联网医院牌照
快速办理通道
 关注我们
关注我们

手机扫码关注公众号
获取最新动态
 返回顶部
返回顶部